Энергетический уровень как найти
Энергетические уровни
ЗНАНИЯ
Энергетические уровни (слои) электронов в атоме:
У орбиталей, кстати, тоже есть и своя энергия. И если несколько орбиталей имеют равную или близкую энергию, то они образуют свой энергетический слой (уровень). Подобно облакам вокруг планеты, которые могут быть на разной высоте и образовывать разные слои.
Каждый энергетический уровень обозначен за n, от единицы и выше (n = 1, n = 2, n = 3,…). Либо в буквах, тогда первый уровень 1 = K, второй 2 = L, третий 3 = M и далее по латинскому алфавиту.
Например, натрий можно изобразить так:
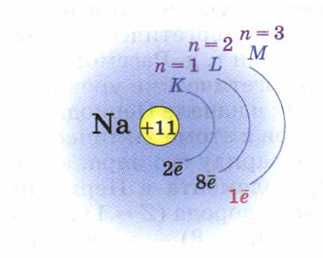
На одном энергетическом уровне (слое) n может находиться n2 орбиталей, больше просто не влезет в слой. Т.е. на 1-м уровне 1 орбиталь, на втором 4 орбитали, на третьем, 9 и т.д. А в каждой орбитали, как вы помните, может быть по 2 электрона, значит максимальное количество электронов на электронном уровне атома: N = 2n2
Значит, уровень 1 имеет 2 электрона, уровень 2 - 8 электронов, уровень 3 - 18 и т.д.
Логично, что первые электроны занимают сначала первый уровень, потом, весь второй, третий и т.д. И снова нам помогает таблица Менделеева, ведь номер периода (строки) соответствует количеству энергетических уровней в элементе.
Например, только у гелия и водорода всего 1 энергетический уровень, причем в гелии он максимально заполнен электронами (на первом уровне их же всего 2).
Во втором ряду как раз 8 элементов, что логично, ведь на втором уровне может быть всего 8 электронов 2n2 = 2*22 = 8
На третьем уровне элементов тоже почему-то 8? Здесь фишка в том, что на внешнем уровне не может быть более 8 электронов. И хотя на третьем уровне может быть максимум 18 электронов 2*32, происходить это может, только если он не последний.
Ничего страшного, все компенсируется на 4-м уровне, где целых 18 элементов.
В периодической таблице также подписаны все электроны на каждом уровне. Посмотрите, там очень мелко в каждой клетке элементов.
uchilegko.info
Строение энергетических уровней
При изучении предыдущей темы мы узнали, чему равно максимальное число электронов на каждой орбитали, на различных энергетических уровнях и подуровнях.
Что еще нужно знать для установления строения электронной оболочки атома любого элемента? Для этого нужно знать порядок заполнения орбиталей электронами.
Порядок заполнения электронами атомных орбиталей определяет принцип наименьшей энергии (принцип минимума энергии):
Основное (устойчивое) состояние атома — это такое состояние, которое характеризуется минимальной энергией. Поэтому электроны заполняют орбитали в порядке увеличения их энергии.
Орбитали одного подуровня имеют одинаковую энергию.
Например, три орбитали данного р-подуровня имеют одинаковую энергию.
Поэтому принцип наименьшей энергии определяет порядок заполнения энергетических подуровней: электроны заполняют энергетические подуровни в порядке увеличения их энергии.
Как показывает рисунок ниже, наименьшую энергию имеет 15-подуровень, который первым заполняется электронами.
Затем последовательно заполняется электронами следующие подуровни: 2s, 2р, 3s, 3р. После 3р-подуровня электроны заполняют 4, подуровень, так как он имеет меньшую энергию, чем 3d-подуровень.
Это объясняется тем, что энергия подуровня определяется суммой главного и побочного квантовых чисел, т. е. суммой (n + l). Чем меньше эта сумма, тем меньше энергия подуровня. Если суммы n + l одинаковы для разных подуровней, то их энергия тем меньше, чем меньше главное квантовое число n. Изложенные правила были сформулированы в 1951 г. советским ученым В. М. Клечковским (правила Клечковского).
На подуровнях, которые показаны на рисунке, может разместиться 112 электронов. В атомах известных элементов находится от 1 до 110 электронов. Поэтому другие подуровни в основных состояниях атомов не заполняются электронами.
Наконец, осталось выяснить вопрос, в каком порядке электроны заполняют орбитам одного подуровня. Для этого нужно познакомиться с правилом Гунда:
На одном подуровне электроны располагаются так, чтобы абсолютное значение суммы спиновых квантовых чисел (суммарного спина) было максимальным. Это соответствует устойчивому состоянию атома.
Рассмотрим, например, какое расположение трех электронов на р-подуровне соответствует устойчивому состоянию атома:
Рассчитаем абсолютное значение суммарного спина для каждого состояния: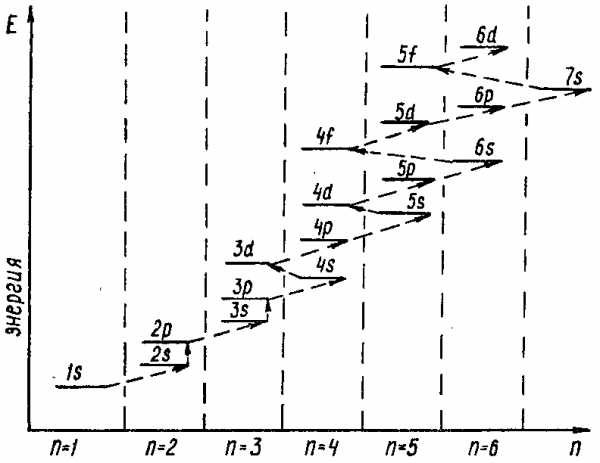
Строение электронных оболочек (электронные конфигурации) атомов элементов I – IV периодов
Чтобы правильно изобразить электронные конфигурации различных атомов, нужно знать:
1) число электронов в атоме (равно порядковому номеру элемента);
2) максимальное число электронов на уровнях, подуровнях;
3) порядок заполнения подуровней и орбиталей.
Элементы I периода: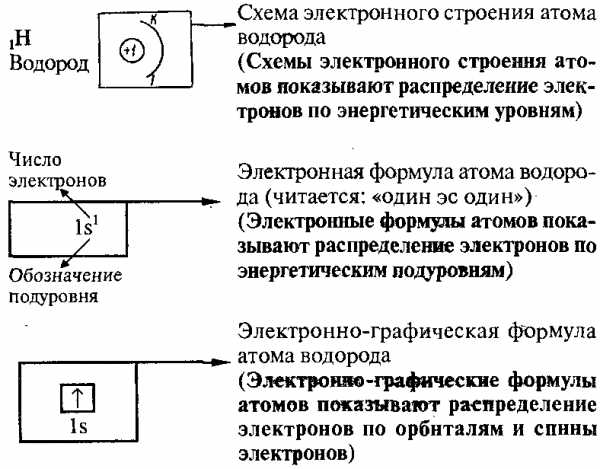
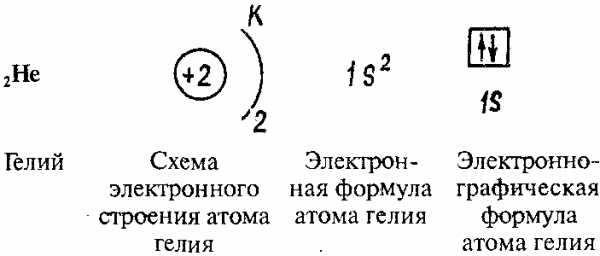
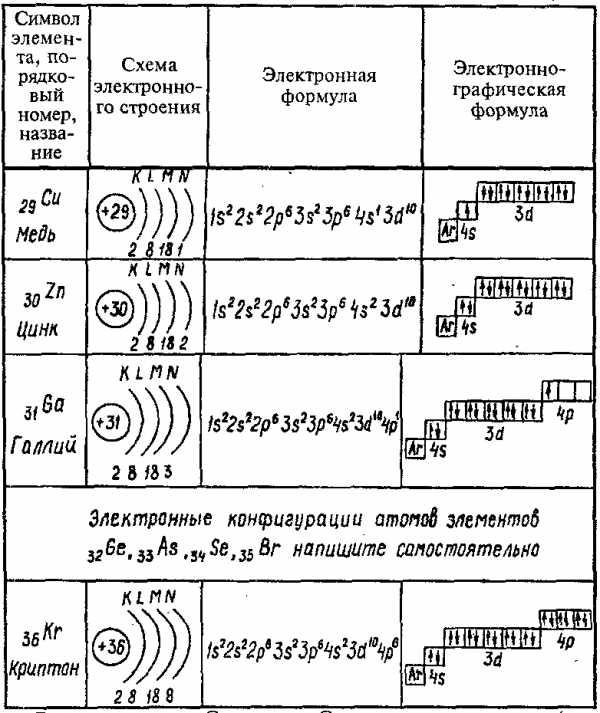
В таблицах представлены схемы электронного строения, электронные и электронно-графические формулы атомов элементов II, III и IV периодов.
Элементы II периода: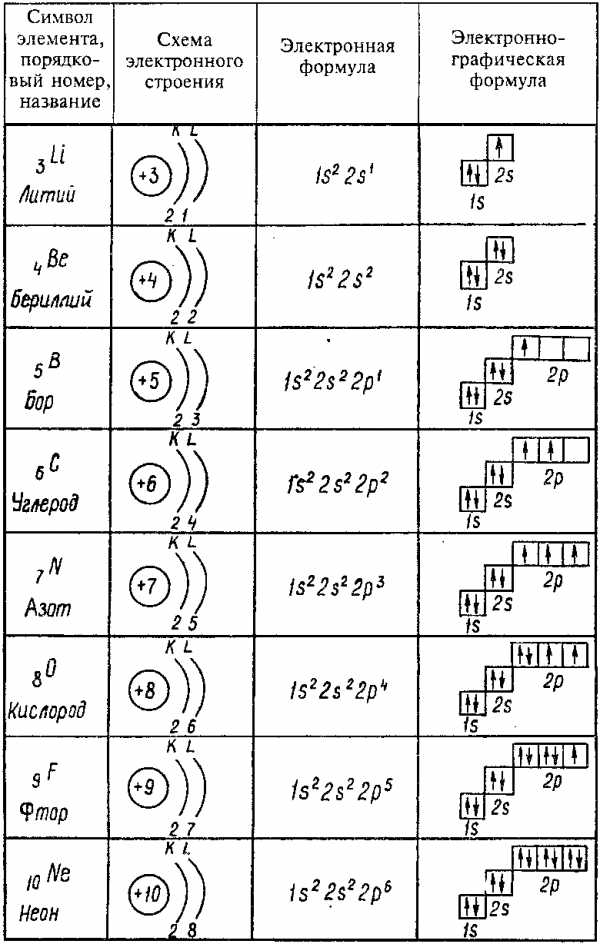
Элементы III периода: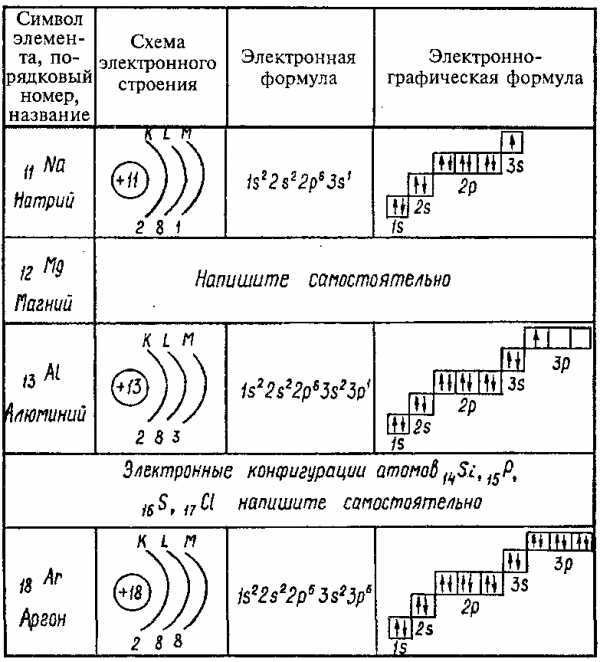
Элементы IV периода: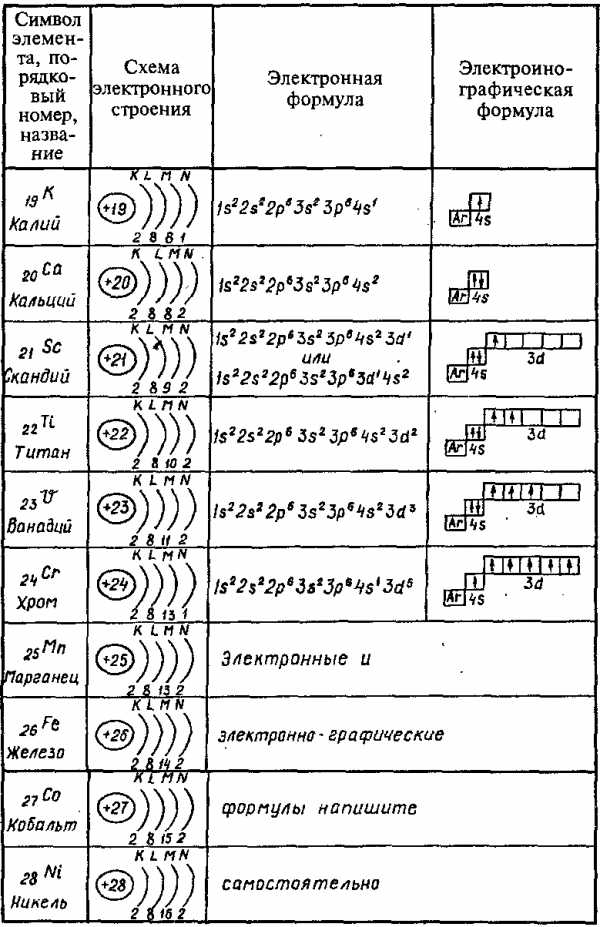
al-himik.ru
Малюгина 14. Внешний и внутренний энергетический уровни. Завершенность энергетического уровня
Малюгина 14. Внешний и внутренний энергетический уровни. Завершенность энергетического уровня.
Вспомним вкратце, что мы уже знаем о строении электронной оболочки атомов:
ü число энергетических уровней атома = номеру периода, в котором находится элемент;
ü максимальная емкость каждого энергетического уровня вычисляется по формуле 2n2
ü внешняя энергетическая оболочка не может содержать для элементов 1 периода более 2-х электронов, для элементов других периодов более 8 электронов
Еще раз вернемся к анализу схемы заполнения энергетических уровней у элементов малых периодов:
Таблица1.Заполнение энергетических уровней
у элементов малых периодов
Номер периода | Количество энергетических уровней = номеру периода | Символ элемента, его порядковый номер | Общее количество электронов | Распределение электронов по энергетическим уровням | Номер группы | |
Схема 1 | Схема 2 | |||||
1 | 1 | 1Н | 1 | Н +1 )1 | +1Н, 1е- | I (VII) |
2Не | 2 | Нe +2 )2 | +2Не, 2е- | VIII | ||
2 | 2 | 3Li | 3 | Li +3 )2 )1 | +3Li, 2е-, 1е- | I |
4Be | 4 | Ве +4 )2 )2 | +4Be, 2е-, 2е- | II | ||
5B | 5 | В +5 )2 )3 | +5В, 2е-, 3е- | III | ||
6C | 6 | С +6 )2 )4 | +6С, 2е-, 4е- | IV | ||
7N | 7 | N +7 )2 )5 | +7N, 2е-, 5е- | V | ||
8O | 8 | O +8 )2 )6 | +8O, 2е-, 6е- | VI | ||
9F | 9 | F +9 )2 )7 | +9F, 2е-, 7е- | VI | ||
10Ne | 10 | Ne +10 )2 )8 | +10Ne, 2е-, 8е- | VIII | ||
3 | 3 | 11Na | 11 | Na +11 )2 )8 )1 | +11Na, 2е-, 8е-, 1e- | I |
12Mg | 12 | Mg +12 )2 )8 )2 | +12Mg, 2е-, 8е-, 2e- | II | ||
13Al | 13 | Al +13 )2 )8 )3 | +13Al, 2е-, 8е-, 3e- | III | ||
14Si | 14 | Si +14 )2 )8 )4 | +14Si, 2е-, 8е-, 4e- | IV | ||
15P | 15 | P +15 )2 )8 )5 | +15P, 2е-, 8е-, 5e- | V | ||
16S | 16 | S +16 )2 )8 )6 | +15P, 2е-, 8е-, 6e- | VI | ||
17Cl | 17 | Cl +17 )2 )8 )7 | +17Cl, 2е-, 8е-, 7e- | VI | ||
18Ar | 18 | Ar +18 )2 )8 )8 | +18Ar, 2е-, 8е-, 8e- | VIII |
Проанализируйте таблицу 1. Сравните число электронов на последнем энергетическом уровне и номер группы, в которой находится химический элемент.
Заметили ли Вы, что число электронов на внешнем энергетическом уровне атомов совпадает с номером группы, в которой находится элемент (исключение составляет гелий)?
!!! Это правило справедливо только для элементов главных подгрупп.
Каждый период системы заканчивается инертным элементом (гелий He, неон Ne, аргон Ar). Внешний энергетический уровень этих элементов содержит максимально возможное число электронов: гелий -2, остальные элементы – 8. Это элементы VIII группы главной подгруппы. Энергетический уровень, схожий со строением энергетического уровня инертного газа, называют завершенным. Это своеобразный предел прочности энергетического уровня для каждого элемента Периодической системы. Молекулы простых веществ – инертных газов состоят из одного атома и отличаются химической инертностью, т. е. практически не вступают в химические реакции.
У остальных элементов ПСХЭ энергетический уровень отличается от энергетического уровня инертного элемента, такие уровни называют незавершенными. Атомы этих элементов стремятся к завершению внешнего энергетического уровня, отдавая или принимая электроны.
Вопросы для самоконтроля
1. Какой энергетический уровень называется внешним?
2. Какой энергетический уровень называется внутренним?
3. Какой энергетический уровень называется завершенным?
4. Элементы какой группы и подгруппы имеют завершенный энергетический уровень?
5. Чему равно число электронов на внешнем энергетическом уровне элементов главных подгрупп?
6. Чем схожи по строению электронного уровня элементы одной главной подгруппы
7. Сколько электронов на внешнем уровне содержат элементы а) IIA группы;
б) IVA группы; в) VII A группы
Посмотреть ответ
1. Последний
2. Любой, кроме последнего
3. Тот, который содержит максимальное число электронов. А также внешний уровень, если он содержит 8 электронов для I периода - 2 электрона.
4. Элементы VIIIA группы (инертные элементы)
5. Номеру группы, в которой находится элемент
6. У всех элементов главных подгрупп на внешнем энергетическом уровне содержится столько электронов, каков номер группы
7. а) у элементов IIA группы на внешнем уровне 2 электрона; б) у элементов IVA группы – 4 электрона; в) у элементов VII A группы – 7 электронов.
Задания для самостоятельного решения
1. Определите элемент по следующим признакам: а) имеет 2 электронных уровня, на внешнем – 3 электрона; б) имеет 3 электронных уровня, на внешнем – 5 электронов. Запишите распределение электронов по энергетическим уровням этих атомов.
2. Какие два атома имеют одинаковое число заполненных энергетических уровней?
а) натрий и водород; б) гелий и водород; в) аргон и неон г) натрий и хлор
3. Сколько электронов находится на внешнем энергетическом уровне магния?
4. Сколько электронов содержится в атоме неона?
5. Какие два атома имеют одинаковое число электронов на внешнем энергетическом уровне: а) натрий и магний; б) кальций и цинк; в) мышьяк и фосфор г) кислород и фтор.
6. На внешнем энергетическом уровне атома серы электронов: а) 16; б) 2; в) 6 г) 4
7. Что общего у атомов серы и кислорода: а) число электронов; б) число энергетических уровней в) номер периода г) число электронов на внешнем уровне.
8. Что общего у атомов магния и фосфора: а) число протонов; б) число энергетических уровней в) номер группы г) число электронов на внешнем уровне.
9. Выберите элемент второго периода, у которого на внешнем уровне находится один электрон: а) литий; б) бериллий; в) кислород; г) натрий
10. На внешнем уровне атома элемента третьего периода находится 4 электрона. Укажите этот элемент: а) натрий; б) углерод в) кремний г) хлор
11. В атоме 2 энергетических уровня, находится 3 электрона. Укажите этот элемент: а) алюминий; б) бор в) магний г) азот
12.
Посмотреть ответ:
1. а) Установим «координаты» химического элемента: 2 электронных уровня – II период; 3 электрона на внешнем уровне – III А группа. Это бор 5B. Схема распределения электронов по энергетическим уровням: 2е-, 3е-
б) III период, VА группа, элемент фосфор 15Р. Схема распределения электронов по энергетическим уровням: 2е-, 8е-, 5е-
2. г) натрий и хлор.
Пояснение: а) натрий: +11 )2 )8 )1 (заполненных 2) ←→ водород: +1 )1
б) гелий: +2 )2 (заполненых 1) ←→ водород: водород: +1 )1
в) гелий: +2 )2 (заполненных 1) ←→ неон : +10 )2 )8 (заполненных 2)
*г) натрий: +11 )2 )8 )1 (заполненных 2) ←→ хлор: +17 )2 )8 )7 (заполненных 2)
3. Два
4. Десять. Число электронов = порядковому номеру
5 в) мышьяк и фосфор. Одинаковое число электронов имеют атомы, расположенные в одной подгруппе.
Пояснения:
а) натрий и магний ( в разных группах); б) кальций и цинк ( в одной группе, но разных подгруппах) ; *в) мышьяк и фосфор (в одной, главной, подгруппе) г) кислород и фтор ( в разных группах).
6. в) 6
7. г) число электронов на внешнем уровне
8. б) число энергетических уровней
9. а) литий (находится в IA группе II периода)
10. в) кремний (IVA группа, III период)
11. б) бор (2 уровня - II период, 3 электрона на внешнем уровне – IIIA группа)
pandia.ru
Внешние энергетические уровни: особенности строения и их роль во взаимодействиях между атомами
Что происходит с атомами элементов во время химических реакций? От чего зависят свойства элементов? На оба эти вопроса можно дать один ответ: причина лежит в строении внешнего энергетического уровня атома. В нашей статье мы рассмотрим электронное строение атомов металлов и неметаллов и выясним зависимость между структурой внешнего уровня и свойствами элементов.
Особые свойства электронов
При прохождении химической реакции между молекулами двух или более реагентов происходят изменения в строении электронных оболочек атомов, тогда как их ядра остаются неизменными. Сначала ознакомимся с характеристиками электронов, находящихся на наиболее удаленных от ядра уровнях атома. Отрицательно заряженные частицы располагаются слоями на определенном расстоянии от ядра и друг от друга. Пространство вокруг ядра, где нахождение электронов наиболее возможно, называется электронной орбиталью. В ней сконденсировано около 90 % отрицательно заряженного электронного облака. Сам электрон в атоме проявляет свойство дуальности, он одновременно может вести себя и как частица, и как волна.
Правила заполнения электронной оболочки атома
Количество энергетических уровней, на которых находятся частицы, равно номеру периода, где располагается элемент. На что же указывает электронный состав? Оказалось, что количество электронов на внешнем энергетическом уровне для s- и p-элементов главных подгрупп малых и больших периодов соответствует номеру группы. Например, у атомов лития первой группы, имеющих два слоя, на внешней оболочке находится один электрон. Атомы серы содержат на последнем энергетическом уровне шесть электронов, так как элемент расположен в главной подгруппе шестой группы и т. д. Если же речь идет о d-элементах, то для них существует следующее правило: количество внешних отрицательных частиц равно 1 (у хрома и меди) или 2. Объясняется это тем, что по мере увеличения заряда ядра атомов вначале происходит заполнение внутреннего d- подуровня и внешние энергетические уровни остаются без изменений.
В периодической системе малыми считаются 1, 2, 3 и 7 периоды. Плавное изменение свойств элементов по мере возрастания ядерных зарядов, начиная от активных металлов и заканчивая инертными газами, объясняется постепенным увеличением количества электронов на внешнем уровне. Первыми элементами в таких периодах являются те, чьи атомы имеют всего один или два электрона, способные легко отрываться от ядра. В этом случае образуется положительно заряженный ион металла.
Амфотерные элементы, например, алюминий или цинк, свои внешние энергетические уровни заполняют небольшим количеством электронов (1- у цинка, 3 – у алюминия). В зависимости от условий протекания химической реакции они могут проявлять как свойства металлов, так и неметаллов. Неметаллические элементы малых периодов содержат от 4 до 7 отрицательных частиц на внешних оболочках своих атомов и завершают ее до октета, притягивая электроны других атомов. Например, неметалл с наибольшим показателем электроотрицательности – фтор, имеет на последнем слое 7 электронов и всегда забирает один электрон не только у металлов, но и у активных неметаллических элементов: кислорода, хлора, азота. Заканчиваются малые периоды, как и большие, инертными газами, чьи одноатомные молекулы имеют полностью завершенные до 8 электронов внешние энергетические уровни.
Четные ряды 4, 5, и 6 периодов состоят из элементов, внешние оболочки которых вмещают всего один или два электрона. Как мы говорили ранее, у них происходит заполнение электронами d- или f- подуровней предпоследнего слоя. Обычно это - типичные металлы. Физические и химические свойства у них изменяются очень медленно. Нечетные ряды вмещают такие элементы, у которых заполняются электронами внешние энергетические уровни по следующей схеме: металлы - амфотерный элемент – неметаллы – инертный газ. Мы уже наблюдали ее проявление во всех малых периодах. Например, в нечетном ряду 4 периода медь является металлом, цинк – амфотерен, затем от галлия и до брома происходит усиление неметаллических свойств. Заканчивается период криптоном, атомы которого имеют полностью завершенную электронную оболочку.
Как объяснить деление элементов на группы?
Каждая группа – а их в короткой форме таблицы восемь, делится еще и на подгруппы, называемые главными и побочными. Такая классификация отражает различное положение электронов на внешнем энергетическом уровне атомов элементов. Оказалось, что у элементов главных подгрупп, например, лития, натрия, калия, рубидия и цезия последний электрон расположен на s-подуровне. Элементы 7 группы главной подгруппы (галогены) заполняют отрицательными частицами свой p-подуровень.
Для представителей побочных подгрупп, таких, как хром, молибден, вольфрам типичным будет наполнение электронами d-подуровня. А у элементов, входящих в семейства лантаноидов и актиноидов, накопление отрицательных зарядов происходит на f-подуровне предпоследнего энергетического уровня. Более того, номер группы, как правило, совпадает с количеством электронов, способных к образованию химических связей.
В нашей статье мы выяснили, какое строение имеют внешние энергетические уровни атомов химических элементов, и определили их роль в межатомных взаимодействиях.
fb.ru